Flavonifractor plautii
| Flavonifractor plautii | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
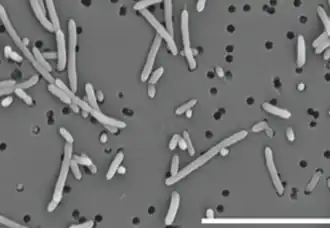
Flavonifractor plautii REM-Aufnahme. 5.000 fache Vergrößerung, Maßstab = 10 μm. | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Flavonifractor plautii | ||||||||||||
| Carlier et al. 2010 |
Flavonifractor plautii ist eine Gattung von Bakterien die im Darm von Menschen und Tieren vorkommt. Es ist in der Lage, verschiedene Flavonoide abzubauen. Die gebildeten Abbauprodukte tragen zu einer besseren viralen Immunabwehr des Menschen bei.[1][2] Dieses Bakterium besitzt auch die Fähigkeit, gesundheitsfördernde kurzkettige Fettsäuren, wie Butyrat und Acetat, zu produzieren.[3][4]
Merkmale
Flavonifractor plautii besitzt mehrere Flagellen, sie sind gleichmäßig über die Zelloberfläche verteilt (peritriche Begeißelung). Die Zellen sind grade Stäbchen mit einer Länge von 2–7 μm und einer Breite von 0,9–1 μm. Sie erscheinen einzeln oder paarweise.[5] Es werden runde bis ovale, subterminal gelegene Sporen gebildet.
Stoffwechsel und Wachstum
Flavonifractor plautii ist strikt anaerob, d. h. Sauerstoff wird nicht toleriert. Der Stoffwechsel ist chemoorganotroph, es findet die Fermentation statt. Die optimale Temperatur für das Wachstum liegt bei 37 °C.
Im flüssigem Nährmedium Pepton-Hefe-Glucose-Bouillon werden Essigsäure und Buttersäure gebildet.[6]
Nutzung
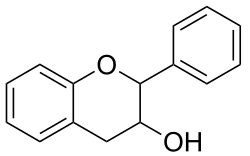
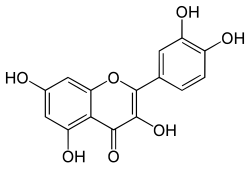
Flavonifractor plautii ist ein Darmbakterium des Menschen und kann verschiedene Flavonoide abbauen und somit die Abbauprodukte für den Menschen verfügbar machen. Andere bekannte Bakterien, die in der Lage sind Flavonoide abzubauen sind z. B. Clostridium scindens, Eubacterium desmolans und Eubacterium ramulus.
Es wurde festgestellt, dass F. plautii Quercetin und Taxifolin zu 3,4-Dihydroxyphenylessigsäure (DOPAC), Luteolin und Eriodictyol[S 1] zu 3-(3,4-Dihydroxyphenyl)propionsäure[S 2] und Apigenin, Naringenin, Phloretin zu 3-(4-Hydroxyphenyl)propionsäure (auch als Desaminotyrosin, DAT oder Phloretinsäure bezeichnet) konvertiert.[1] Desaminotyrosin wirkt aktivierend auf das Immunsystem und verringert die Schädigung vom Lungengewebe durch Influenzaviren und kann auch einen Schutz gegen SARS-CoV-2-Infektionen bieten. Es stärkt den IFN-I-Signalweg zur Unterdrückung der Virusreplikation. Auch bei anderen Bakterien, wie Lactiplantibacillus pentosus und Clostridium sporogenes, wurde dies beobachtet.[7][8][9]
F. plautii scheint als Antiallergikum einsetzbar. Das von ihm gebildete Catechin, eine Gruppe polyphenolischer Verbindungen wie Epigallocatechin-3-O-(3-O-methyl)-Gallat (EGCG3 "Me) und Epigallocatechin-3-O-(4-O-methyl)-Gallat (EGCG4 "Me), wirkt eine starke antiallergische Wirkungen aus. Die meisten im Tee enthaltenen Katechine werden von der Darmmikrobiota umgewandelt und dann in den Blutkreislauf aufgenommen.[10]
Pathogenität
F. plautii kann beim Menschen auch Krankheiten hervorrufen, es gilt als opportunistischer Krankheitserreger. So wurde berichtet, dass diese Spezies an verschiedenen Infektionen beteiligt ist, darunter Meningitis und Bakteriämie. F. plautii scheint des Weiteren bei Morbus-Crohn-Patienten eine entzündungsfördernde Wirkung zu haben.[6]
Darüber hinaus wurde vermutet, dass seine Fähigkeit, schützende, antikarzinogene Flavonoide abzubauen, mit dem Fortschreiten von Darmkrebs in Verbindung steht.[6] Interessanterweise war die relative Häufigkeit von F. plautii auch im Blinddarm von Mäusen, die in einem Versuch chronischem Stress durch Erhöhte Schwerkraft ausgesetzt wurden, deutlich erhöht.[11]
Es wurde beschrieben, dass sich die Darmmikrobiota-Gemeinschaft zwischen Patienten mit neu diagnostizierter bipolarer Störung und gesunden Personen unterscheidet. Eine neu diagnostizierte bipolare Erkrankung war mit der Prävalenz von Flavonifractor verbunden. Das Vorhandensein von Flavonifractor beeinflusst möglicherweise oxidativen Stress und Entzündungen in seinem Wirt und könnte möglicherweise die Darmmikrobiota mit der Krankheitspathologie der bipolaren Störung in Verbindung bringen.[12][13]
Systematik
Die Geschichte der einzelnen Arten der Gattung Flavonifractor begann 1907 mit der Beschreibung beweglicher fusiformer Stäbchen durch Plaut im Jahr 1907, die aus menschlicher Ulzeromembranöse Stomatitis isoliert wurden und später von Séguin im Jahr 1928 als Fusobacterium plauti (plauti nur mit einem i geschrieben) bezeichnet wurden (Séguin, 1928). Anhand von Fettsäuremustern und elektronenmikroskopischen Untersuchungen der Zellwand wiesen Hofstad und Aasjord im Jahr 1982 nach, dass es sich bei Fusobacterium plautii VPI 0310 um einen Gram-positiven Mikroorganismus handelt, und ordneten diese Art der Gattung Eubacterium zu. Auf der Grundlage ihrer Beobachtung schlugen die Autoren vor, dass das ursprünglich von Plaut beobachtete orale fusiforme Bakterium wahrscheinlich ein Selenomonas sp. und nicht Eubacterium plautii war. Im Jahr 1991 wurde Clostridium orbiscindens von Winter et al. beschrieben.[5] Aufgrund molekularer, biochemischer und genomischer Beweise schlugen Carlier et al. 2010 vor, E. plautii und Clostridium orbiscindens in einer neuen Gattung als Flavonifractor plautii gen. nov., comb. nov. zu vereinen.[6]
Einzelnachweise
- ↑ a b Lilian Schoefer, Ruchika Mohan, Andreas Schwiertz, Annett Braune, Michael Blaut: Anaerobic Degradation of Flavonoids by Clostridium orbiscindens. In: Applied and Environmental Microbiology. Band 69, Nr. 10, 1. Oktober 2003, S. 5849–5854, doi:10.1128/AEM.69.10.5849-5854.2003, PMID 14532034, PMC 201214 (freier Volltext) – (englisch).
- ↑ Deniz Cicek-Görkem: Grippeschutz mit Flavonoiden und Darmbakterien. In: APOTHEKE ADHOC. EL PATO Medien, 14. August 2017, abgerufen am 10. Oktober 2022.
- ↑ Fred A. Rainey Becky Jo Hollen und lanna M. Small: Clostridium In: Bergey’s Manual of Systematics of Archaea and Bacteria, 2015, John Wiley & Sons, Inc., in association with Bergey’s Manual Trust. doi:10.1002/9781118960608.gbm00619
- ↑ Gina Paola Rodriguez-Castaño, Federico E. Rey, Alejandro Caro-Quintero, Alejandro Acosta-González: Gut-derived Flavonifractor species variants are differentially enriched during in vitro incubation with quercetin. In: PLOS ONE. Band 15, Nr. 12, 2. Dezember 2020, ISSN 1932-6203, S. e0227724, doi:10.1371/journal.pone.0227724, PMID 33264299, PMC 7710108 (freier Volltext) – (plos.org [abgerufen am 26. April 2025]).
- ↑ a b J. Winter, M. R. Popoff, P. Grimont, V. D Bokkenheuser: Clostridium orbiscindens sp. nov., a human intestinal bacterium capable of cleaving the flavonoid C-ring In: International Journal of Systematic and Evolutionary Microbiology (1991), Band 41, Ausgabe 3, S. 355-7. doi:10.1099/00207713-41-3-355.
- ↑ a b c d Corentine Alauzet, Alain Lozniewski und Catherine Cailliez-Grimal: Flavonifractor (2023) In: Bergey's Manual of Systematics of Archaea and Bacteria. 1. Auflage. Wiley, 2015, ISBN 978-1-118-96060-8, doi:10.1002/9781118960608.gbm01733 (wiley.com [abgerufen am 24. April 2025]).
- ↑ Aya Al Ali, Walaa K. Mousa: Role of Microbiome in Defense. In: Metabolic Dynamics in Host-Microbe Interaction. Springer Nature Singapore, Singapore 2025, ISBN 978-981-9613-04-5, S. 377–410, doi:10.1007/978-981-96-1305-2_15 (springer.com [abgerufen am 26. April 2025]).
- ↑ Yanxia Wei, Jing Gao, Yanbo Kou, Mengnan Liu, Liyuan Meng, Xingping Zheng, Shihong Xu, Ming Liang, Hongxiang Sun, Zhuanzhuan Liu, Yugang Wang: The intestinal microbial metabolite desaminotyrosine is an anti‐inflammatory molecule that modulates local and systemic immune homeostasis. In: The FASEB Journal. Band 34, Nr. 12, Dezember 2020, ISSN 0892-6638, S. 16117–16128, doi:10.1096/fj.201902900RR (wiley.com [abgerufen am 26. April 2025]).
- ↑ Ashley L. Steed, George P. Christophi, Gerard E. Kaiko, Lulu Sun, Victoria M. Goodwin, Umang Jain, Ekaterina Esaulova, Maxim N. Artyomov, David J. Morales, Michael J. Holtzman, Adrianus C. M. Boon, Deborah J. Lenschow und Thaddeus S. Stappenbeck: The microbial metabolite desaminotyrosine protects from influenza through type I interferon. In: Science, 4 Aug. 2017, Band 357, Ausgabe 6350, S. 498–502 doi:10.1126/science.aam5336
- ↑ Tasuku Ogita, Yoshinari Yamamoto, Ayane Mikami, Suguru Shigemori, Takashi Sato, Takeshi Shimosato: Oral Administration of Flavonifractor plautii Strongly Suppresses Th2 Immune Responses in Mice. In: Frontiers in Immunology. Band 11, 28. Februar 2020, ISSN 1664-3224, doi:10.3389/fimmu.2020.00379, PMID 32184789, PMC 7058663 (freier Volltext) – (frontiersin.org [abgerufen am 25. April 2025]).
- ↑ Corentine Alauzet, Lisiane Cunat, Maxime Wack, Alain Lozniewski, Hélène Busby, Nelly Agrinier, Catherine Cailliez-Grimal, Jean-Pol Frippiat: Hypergravity disrupts murine intestinal microbiota. In: Scientific Reports. Band 9, Nr. 1, 28. Juni 2019, ISSN 2045-2322, doi:10.1038/s41598-019-45153-8, PMID 31253829, PMC 6599200 (freier Volltext) – (nature.com [abgerufen am 23. April 2025]).
- ↑ Lipi Poojara, Dhaval K. Acharya, Jalpa Patel, Rakesh M. Rawal: Gut–Brain Axis: Role of the Gut Microbiome on Human Health. In: Microbiome-Gut-Brain Axis. Springer Nature Singapore, Singapore 2022, ISBN 978-981-16-1625-9, S. 187–211, doi:10.1007/978-981-16-1626-6_8 (springer.com [abgerufen am 24. April 2025]).
- ↑ Mohamed Genedi, Jenny Borkent, Magda Iouannou, Isabelle Janmaat, Benno Haarman, Iris E. >Sommer: Gut Microbiome in Patients with Schizophrenia and Bipolar Disorder. In: Immuno-Psychiatry. Springer International Publishing, Cham 2021, ISBN 978-3-03071228-0, S. 195–212, doi:10.1007/978-3-030-71229-7_12 (springer.com [abgerufen am 25. April 2025]).
Externe Links zu erwähnten Verbindungen
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Eriodictyol: CAS-Nr.: 552-58-9, EG-Nr.: 209-016-4, ECHA-InfoCard: 100.008.198, PubChem: 440735, ChemSpider: 389606, Wikidata: Q3459685.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 3-(3,4-Dihydroxyphenyl)propionsäure: CAS-Nr.: 1078-61-1, EG-Nr.: 214-083-8, ECHA-InfoCard: 100.012.804, PubChem: 348154, ChemSpider: 308986, Wikidata: Q10395580.