Hexaethyldiblei
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
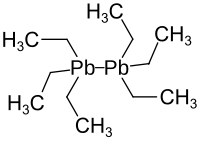
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Hexaethyldiblei | ||||||||||||||||||
| Summenformel | Pb2C12H30 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 588,77 g·mol−1 | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Hexaethyldiblei ist eine chemische Verbindung aus der Gruppe der bleiorganische Verbindung. Sie ist aus zwei miteinander verbundenen Bleiatomen mit insgesamt sechs Ethylgruppen aufgebaut.
Herstellung
Hexaethyldiblei kann durch Reduktion von Triethylbleihalogeniden hergestellt werden, beispielsweise durch die elektrochemische Reduktion von Triethylbleibromid[S 1] and einer Kathode aus elementarem Blei.[3] Auch die Reduktion von Triethylbleichlorid[S 2] oder Diethylbleidichlorid[S 3] mit Zink in wässriger Lösung ist möglich.[4] Schließlich kann es als Nebenprodukt in Reaktionen zur Herstellung von Tetraethylblei entstehen.[5]
Nachweis
Nachweis durch Polarographie in einem Lösungsmittelgemisch aus Benzol und Methanol (1:1) mit Lithiumchlorid als zusätzlichem Elektrolyt.[5]
Einzelnachweise
- ↑ Eintrag zu Bleiverbindungen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 15. November 2024. (JavaScript erforderlich)
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag Bleiverbindungen in der Datenbank ECHA CHEM der Europäischen Chemikalienagentur (ECHA), abgerufen am 15. November 2024. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Bernard Fleet, N.B. Fouzder: Electrochemical behaviour of organolead compounds. In: Journal of Electroanalytical Chemistry and Interfacial Electrochemistry. Band 99, Nr. 2, Mai 1979, S. 215–225, doi:10.1016/S0022-0728(79)80249-1.
- ↑ Martin H. Hitchen, A. Kenneth Holliday, Richard J. Puddephatt: Organolead chemistry. In: Journal of Organometallic Chemistry. Band 184, Nr. 3, Januar 1980, S. 335–342, doi:10.1016/S0022-328X(00)93760-4.
- ↑ a b J. E. De Vries, Allen. Lauw-Zecha, Ana. Pellecer: Polarographic Determination of Hexaethyldilead in Tetraethyllead. In: Analytical Chemistry. Band 31, Nr. 12, 1. Dezember 1959, S. 1995–1997, doi:10.1021/ac60156a033.
Externe Links zu erwähnten Verbindungen
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Triethylbleibromid: CAS-Nr.: 41141-89-3, EG-Nr.: 621-229-8, ECHA-InfoCard: 100.150.101, PubChem: 306022, ChemSpider: 270556, Wikidata: Q82056223.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Triethylbleichlorid: CAS-Nr.: 1067-14-7, EG-Nr.: 213-925-1, ECHA-InfoCard: 100.012.660, PubChem: 14019, ChemSpider: 13401, Wikidata: Q26841241.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Diethylbleidichlorid: CAS-Nr.: 13231-90-8, EG-Nr.: 621-088-2, ECHA-InfoCard: 100.149.973, PubChem: 316526, Wikidata: Q81986181.


