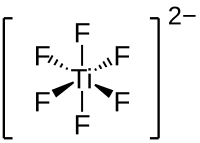
Lithiumhexafluortitanat
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| Allgemeines | ||||||||||
| Name | Lithiumhexafluortitanat | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | Li2TiF6 | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 175,8 g·mol−1 | |||||||||
| Aggregatzustand |
fest[1] | |||||||||
| Dichte | ||||||||||
| Schmelzpunkt | ||||||||||
| Löslichkeit |
löslich in Wasser[4] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Lithiumhexafluortitanat ist eine anorganische chemische Verbindung des Lithiums aus der Gruppe der Titanate.
Gewinnung und Darstellung
Lithiumhexafluortitanat kann durch Zugabe von Lithiumcarbonat zu einer Lösung von Titandioxid in Flusssäure gewonnen werden.[3][6]
Ebenfalls möglich ist die Reaktion Titandioxid mit Fluorwasserstoff und Lithiumfluorid.[6]
Das Dihydrat kann durch Kristallisation des Anhydrats aus 40%iger wässriger Flusssäure hergestellt werden.[1]
Eigenschaften
Lithiumhexafluortitanat ist ein Feststoff, der sich im Vakuum ab 485 °C zu zersetzen beginnt.[3][6]
An feuchter Luft tritt ab 400 °C eine Hydrolyse ein.[3][6]
Lithiumhexafluortitanat besitzt unter normalen Bedingungen eine hexagonale Kristallstruktur mit der Raumgruppe P42/mnm (Raumgruppen-Nr. 136). Bei hohem Druck und Temperatur tritt ein Phasenübergang zu einer anderen Kristallstruktur auf.[2]
Das Dihydrat besitzt eine monokline Kristallstruktur mit Raumgruppe C2/m (Raumgruppen-Nr. 12).[1]
Verwendung
Lithiumhexafluortitanat kann als Beschichtungsmaterial in Lithiumionenbatterien verwendet werden.[7]
Einzelnachweise
- ↑ a b c d E. A. Marseglia, I. D. Brown: Lithium hexafluorotitanate dihydrate and lithium hexafluorostannate dihydrate. In: Acta Crystallographica Section B: Structural Crystallography and Crystal Chemistry. Band 29, Nr. 6, 1973, S. 1352–1354, doi:10.1107/S0567740873004498.
- ↑ a b Evgenievich Tonkov: High Pressure Phase Transformations. Gordon and Breach Science Publishers, 1992, ISBN 978-2-88124-759-0, S. 383 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c d George J. Janz, Max R. Lorenz, Charls T. Brown: Preparation and Thermal Stability of Lithium Titanium Fluoride. In: Journal of the American Chemical Society. Band 80, Nr. 16, 1958, S. 4126–4128, doi:10.1021/ja01549a003.
- ↑ Iosif Grigorʹevich Ryss: The Chemistry of Fluorine and Its Inorganic Compounds. State Publishing House for Scientific, Technical and Chemical Literature, 1960, S. 772 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b c d E. L. Tikhomirova, D. P. Nesterov, O. G. Gromov, E. P. Lokshin, V. T. Kalinnikov: Synthesis of lithium hexafluorotitanate. In: Russian Journal of Applied Chemistry. Band 86, Nr. 6, 2013, S. 831–835, doi:10.1134/S1070427213060074.
- ↑ Wonchang Choi, Anass Benayard, Jin-Hwan Park, Junho Park, Seok-Gwang Doo, Junyoung Mun: Versatile Coating of Lithium Conductive Li2TiF6 on Over-lithiated Layered Oxide in Lithium-Ion Batteries. In: Electrochimica Acta. Band 117, 2014, S. 492–497, doi:10.1016/j.electacta.2013.11.184.