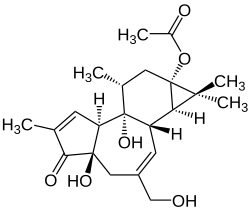
Prostratin
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
| Allgemeines | |||||||
| Name | Prostratin | ||||||
| Andere Namen |
12-Deoxyphorbol-13-acetat[1] | ||||||
| Summenformel | C22H30O6 | ||||||
| Kurzbeschreibung |
amorpher, weißer bis beiger Feststoff[2] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 390,47 g·mol−1 | ||||||
| Aggregatzustand |
fest[2] | ||||||
| Schmelzpunkt | |||||||
| Sicherheitshinweise | |||||||
| |||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||
Prostatin ist ein Diterpenoid, das aus verschiedenen Pflanzen gewonnen werden kann. Es ist vor allem aufgrund seiner möglichen Anwendung als Ergänzung zur aktuellen HIV-Therapie mit Antiretroviraler Therapie (ART) von Interesse.
Struktur und Eigenschaften
Prostratin weist starke strukturelle Ähnlichkeiten zu Phorbol, einem Naturstoff, der vorwiegend in Wolfsmilchgewächsen vorkommt, auf. Wegen dieser strukturellen Ähnlichkeit wird Prostratin auch als 12-Deoxyphorbol-13-acetat bezeichnet. Prostratin ist der Gruppe der Phorbolester zuzuordnen.[3]
Bei Raumtemperatur liegt Prostratin amorph als weiß bis beigefarbenes Pulver vor und besitzt eine molare Masse von 390,47 g mol−1. Der Schmelzpunkt bei Atmosphärendruck liegt bei 217–218 °C.[2] Prostratin ist lichtempfindlich und sollte daher bei −20 °C lichtgeschützt gelagert werden.[4] Aufgrund der chiralen Zentren im Molekül ist Prostratin optisch aktiv. Es dreht die Schwingungsebene von linear polarisiertem Licht nach rechts mit einem spezifischen Drehwinkel von α = +64 ° (in Methanol).[5]
In der Struktur von Prostratin liegen mit den Hydroxy- und Carboxy-Gruppen als hydrophile Gruppen vor, während das tetracyclische Ringsystem lipophil ist. Dieser amphiphile Charakter bedingt die Löslichkeit in Dimethylsulfoxid (DMSO), Dimethylformamid (DMF) und Ethanol.[6] In Wasser ist es nahezu unlöslich.
Biologische Wirkung und Anwendung
Biologische Wirkung
Viele Phorbolester wie zum Beispiel Phorbol-12-myristat‑13‑acetat (PMA) sind weiterhin tumorfördernd. Prostratin zeigt diese tumorfördernde Eigenschaft nicht.
Die biologische Wirkung von Prostratin ist besonders im Zusammenhang mit dem Humanen Immundefizienz-Virus (HIV) untersucht worden. Prostratin zeigt protektive Effekte gegen HIV-induzierte Zytolyse. Weiterhin aktiviert Prostratin latent integrierte HIV-Proviren in CD4+ T-Zellen.[7] Die Wirkung von Prostratin basiert dabei im Wesentlichen auf der Aktivierung der Protein Kinase C (PKC). Diese Aktivierung führt zum Herunterregulieren des HIV-Eintrittsrezeptors CD4 und CCR5. Dadurch können HIV-Partikel schlechter in die Zellen eindringen.[8] Die Aktivierung der Proteinkinase C und damit die Wirkung auf HIV-infizierte Zellen ist bei vielen Phorbolestern zu finden und teilweise stärker ausgeprägt als die des Prostratins. Prostratin zeichnet sich dadurch aus, dass es kein tumorpromotorisches Potenzial aufweist. Dadurch ist es attraktiv für medizinische Anwendungen.[9]
Anwendung
Pflanzenextrakte, die Prostratin enthalten, werden bzw. wurden von der indigenen Bevölkerung Samoas zu medizinischen Zwecken genutzt.[10]
In der Behandlung von HIV ist Prostratin ein präklinischer Wirkstoffkandidat für die Unterstützung der Antiretroviralen Therapie (ART).[11]
Gewinnung und Herstellung
Gewinnung aus Pflanzen
Prostratin kann aus verschiedenen Pflanzen gewonnen werden, die den Stoff enthalten. Die Extraktion ist jedoch sehr aufwendig und liefert nur geringe Mengen Prostratin, z. B. Pimelea prostrata und Homoalanthus nutans. Neben mehrschrittigen Extraktionen mit organischen Lösungsmitteln ist außerdem eine chromatographische Trennung nötig.[2]
Synthese
Totalsynthese
Die Totalsynthese von Prostratin erfolgt über komplexe mehrstufige Synthesen. Ein 23-stufiger Syntheseweg wurde 2018 von Tong, Liu und Li vorgestellt. Ausgehend von einem Cyclopentenderivat werden die vier Ringe des Grundgerüsts der Diterpene gebildet und funktionalisiert. Die Arbeit von Tong et al stellt die erste Totalsynthese für Prostratin dar.[12]
Partialsynthese
Wender et al. haben 2008 eine Partialsynthese von Prostratinausgehend von Phorbol veröffentlicht. Phorbol besitzt als Diterpen bereits einen Großteil der funktionellen Gruppen sowie das Kohlenstoffgerüst des Prostratins. Es ist eine Synthese in vier Schritten möglich.[13]
Einzelnachweise
- ↑ a b c d Datenblatt Prostratin bei Sigma-Aldrich, abgerufen am 5. September 2025 (PDF).
- ↑ a b c d e Kirk R. Gustafson, John H. Cardellina, James B. McMahon, Robert J. Gulakowski, Junichi Ishitoya, Zoltan Szallasi, Nancy E. Lewin, Peter M. Blumberg, Owen S. Weislow: A nonpromoting phorbol from the Samoan medicinal plant Homalanthus nutans inhibits cell killing by HIV-1. In: Journal of Medicinal Chemistry. Band 35, Nr. 11, Mai 1992, ISSN 0022-2623, S. 1978–1986, doi:10.1021/jm00089a006 (acs.org [abgerufen am 6. September 2025]).
- ↑ Gunjan Goel, Harinder P. S. Makkar, George Francis, Klaus Becker: Phorbol Esters: Structure, Biological Activity, and Toxicity in Animals. In: International Journal of Toxicology. Band 26, Nr. 4, Juli 2007, ISSN 1091-5818, S. 279–288, doi:10.1080/10915810701464641 (sagepub.com [abgerufen am 6. September 2025]).
- ↑ Prostratin | PKC Activator | MedChemExpress. Abgerufen am 6. September 2025.
- ↑ Kirk R. Gustafson, John H. Cardellina, James B. McMahon, Robert J. Gulakowski, Junichi Ishitoya, Zoltan Szallasi, Nancy E. Lewin, Peter M. Blumberg, Owen S. Weislow: A nonpromoting phorbol from the Samoan medicinal plant Homalanthus nutans inhibits cell killing by HIV-1. In: Journal of Medicinal Chemistry. Band 35, Nr. 11, Mai 1992, ISSN 0022-2623, S. 1978–1986, doi:10.1021/jm00089a006 (acs.org [abgerufen am 6. September 2025]).
- ↑ Prostratin (CAS 60857-08-1). Abgerufen am 6. September 2025 (englisch).
- ↑ Samuel A. Williams, Lin-Feng Chen, Hakju Kwon, David Fenard, Dwayne Bisgrove, Eric Verdin, Warner C. Greene: Prostratin Antagonizes HIV Latency by Activating NF-κB. In: Journal of Biological Chemistry. Band 279, Nr. 40, Oktober 2004, S. 42008–42017, doi:10.1074/jbc.M402124200 (elsevier.com [abgerufen am 6. September 2025]).
- ↑ R Gulakowski, J Mcmahon, R Buckheit, K Gustafson, M Boyd: Antireplicative and anticytopathic activities of prostratin, a non-tumor-promoting phorbol ester, against human immunodeficiency virus (HIV)1. In: Antiviral Research. Band 33, Nr. 2, Januar 1997, S. 87–97, doi:10.1016/S0166-3542(96)01004-2 (elsevier.com [abgerufen am 6. September 2025]).
- ↑ R Gulakowski, J Mcmahon, R Buckheit, K Gustafson, M Boyd: Antireplicative and anticytopathic activities of prostratin, a non-tumor-promoting phorbol ester, against human immunodeficiency virus (HIV)1. In: Antiviral Research. Band 33, Nr. 2, Januar 1997, S. 87–97, doi:10.1016/S0166-3542(96)01004-2 (elsevier.com [abgerufen am 6. September 2025]).
- ↑ Dyke Gita Wirasisya, Judit Hohmann: An overview of the traditional use, phytochemistry, and biological activity of the genus Homalanthus. In: Fitoterapia. Band 166, April 2023, S. 105466, doi:10.1016/j.fitote.2023.105466 (elsevier.com [abgerufen am 6. September 2025]).
- ↑ Beans, Elizabeth J.; Fournogerakis, Dennis; Gauntlett, Carolyn; Heumann, Lars V.; Kramer, Rainer; Marsden, Matthew D.; Murray, Danielle; Chun, Tae-Wook; Zack, Jerome A.; Wender, Paul A.: Highly potent, synthetically accessible prostratin analogs induce latent HIV expression in vitro and ex vivo. In: Proceedings of the National Academy of Sciences of the United States of America. Nr. 29, Juni 2013, S. 11698–11703.
- ↑ Guanghu Tong, Zhi Liu, Pengfei Li: Total Synthesis of (±)-Prostratin. In: Chem. Band 4, Nr. 12, Dezember 2018, S. 2944–2954, doi:10.1016/j.chempr.2018.10.002 (elsevier.com [abgerufen am 5. September 2025]).
- ↑ Wender, Paul A.; Kee, Jung-Min; Warrington, Jeffrey M.: Practical synthesis of prostratin, DPP, and their analogs, adjuvant leads against latent HIV. In: Science (New York, N.Y.). Nr. 5876. New York 2008, S. 649–652, doi:10.1126/science.1154690, PMID 18451298.