Zirconium(III)-fluorid
| Kristallstruktur | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
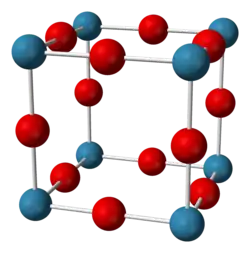
| ||||||||||
| _ Zr3+ _ F− | ||||||||||
| Allgemeines | ||||||||||
| Name | Zirconium(III)-fluorid | |||||||||
| Andere Namen |
| |||||||||
| Verhältnisformel | ZrF3 | |||||||||
| Kurzbeschreibung |
bläulich-grauer Feststoff[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 148,22 g·mol−1 | |||||||||
| Aggregatzustand |
fest[1] | |||||||||
| Dichte |
4,26 g·cm−3[1] | |||||||||
| Schmelzpunkt | ||||||||||
| Löslichkeit |
schwer löslich in heißem Wasser[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Zirconium(III)-fluorid ist eine chemische Verbindung des Zirconiums aus der Gruppe der Fluoride.
Gewinnung und Darstellung
Zirconium(III)-fluorid kann durch Reaktion von hydriertem Zirconium mit einem Gemisch aus Fluorwasserstoff und Wasserstoff bei 750 °C gewonnen werden.[1]
Ebenfalls möglich ist die Darstellung durch Reduktion von (NH4)2ZrF6 mit Wasserstoff bei 650 °C.[3]
Eigenschaften
Zirconium(III)-fluorid ist ein bläulich-grauer Feststoff, der thermisch bis 300 °C stabil ist. Er ist schwer löslich in heißem Wasser, leicht löslich in heißen Säuren sowie unlöslich in Natronlauge und Ammoniaklösung. Seine Kristallstruktur entspricht der von Rhenium(VI)-oxid.[1]
Einzelnachweise
- ↑ a b c d e f g Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 259.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Paul Ehrlich, Fritz Plöger, Ernst Koch, Gustav Kaupa: Über Zirkonium(III)-fluorid. Versuche zur Darstellung von Thorium(III)-fluorid. In: Zeitschrift für anorganische und allgemeine Chemie. 333, 1964, S. 209–215, doi:10.1002/zaac.19643330407.